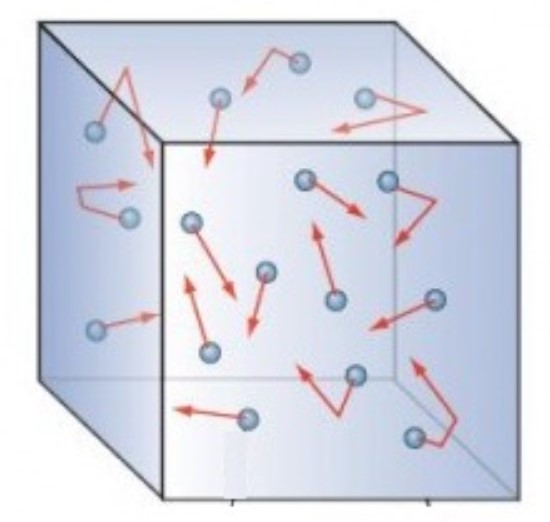
Sekarang setelah kita mendefinisikan sifat-sifat gas ideal, mari kita lihat sifat makroskopik gas tersebut. Sifat makroskopik gas ideal dimulai dengan studi eksperimental. Dari penelitian ini dibangun rumus empiris, yaitu rumus yang diduga memenuhi data observasi. Para fisikawan kemudian membangun landasan teori mengapa sifat-sifat gas ideal diamati (diukur).
Konsep Mol pada Gas Ideal
Gas ideal sendiri akan berhubungan dengan konsep mol. Konsep mol ini dapat digunakan sebagai pengaturan dalam menyatakan jumlah zat yang terkandung pada gas. Pada Satuan Internasional, konsep mol dinyatakan sebagai sebuah besaran sebagai penentuan jumlah zat.
Baca Juga: Pembahasan dan Cara Menentukan Pereaksi Pembatas
Baca Juga: Sifat Besi Secara Kimia dan Secara Fisika
Baca Juga: Mengenal Asam Karboksilat, Tata Nama dan Sifat-Sifatnya
Pada konsep mol, akan diketahui penghitungan yang dipahami dengan pembahasan pada 1 mol zat memiliki jumlah 6,022 x 1023 partikel yang terkandung di dalamnya.
Mol (n) adalah satuan pengukuran pada Sistem Satuan Internasional (SI) untuk jumlah zat. Satuan mol sendiri didefinisikan sebagai jumlah zat kimia yang mengandung jumlah partikel representatif, misalnya pada atom, molekul, ion, elektron, ataupun foton. Jumlah mol ini setara dengan jumlah 12 gram karbon-12 (12C).
1. Konsep Mol pada Ar dan Mr
Mol (n) dirumuskan dengan:

atau

Dalam 1 mol zat terdapat 6,02×1023 partikel, dengan demikian dirumuskan:
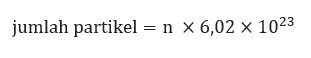
Keterangan:
n: mol
6,02×1023 : bilangan Avogadro
Mr : massa molekul relatif
Ar: massa atom relatif
2. Konsep Mol pada STP (Standard Temperature and Pressure)
Pada kondisi standar dimana suhu 0oC dan tekanan 1 atm, maka disebutlah pada keadaan STP (Standard Temperature and Pressure). Pada keadaan STP, 1 mol gas setara dengan 22,4 Liter. Maka:

Untuk mengetahui jumlah mol suatu molekul, maka bisa menggunakan rumus:
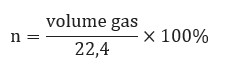
3. Konsep Mol pada Gas Ideal
Pada kondisi gas ideal, maka didapat rumus:
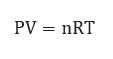
Dengan demikian, maka untuk mencari mol didapatkan rumus:
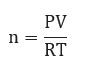
Keterangan:
P: tekanan (atm)
V: volume (liter)
n: mol
R: tetapan gas ideal 0,08205 atm.L/mol.K
T: suhu (kelvin)
4. Konsep Mol pada Suhu dan Tekanan Sama
Pada kondisi suhu dan tekanan sama, maka mol dapat menggunakan rumus: