Baca juga: Pembahasan dan Cara Menentukan Pereaksi Pembatas
Baca juga: Kelipatan Persekutuan Terkecil dan Contoh Soal
4. Ikatan Kovalen Koordinasi
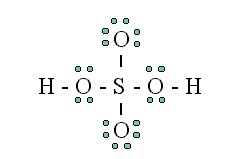
Ikatan kovalen koordinasi pada molekul H2SO4 (sumber gambar: mikeblaber.com)
Ikatan kovalen koordinasi merupakan jenis ikatan kovalen yang dibedakan berdasarkan sumber elektron yang akan dipakai bersama. Ikatan kovalen koordinasi adalah ikatan yang terjadi kalau hanya ada satu atom aja yang menyumbangkan pasangan elektron. Jadi, atom pasangannya tidak bisa menyumbangkan elektron.
5. Ikatan Kovalen Polar
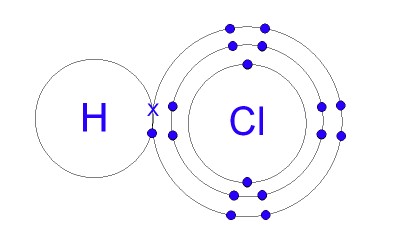
Ikatan HCl merupakan contoh ikatan polar (sumber gambar: gcsescience.com)
Ikatan kovalen polar terjadi ketika pasangan elektron ikatan tertarik lebih kuat ke salah satu atom. Hal ini karena adanya perbedaan keelektronegatifan antar atom tersebut. Makin besar selisihnya, maka akan makin besar pula kepolaran ikatannya. Contohnya adalah H-Cl, dimana keelektronegatifan atom Cl adalah 3,0 sedangkan atom H nilainya 2,1.
6. Ikatan Kovalen Non-polar
Sedangkan ikatan kovalen non polar, pasangan elektron ikatannya akan sama kuat ke semua atom. Dimana keelektronegatifan antar ikatannya sama. Contohnya adalah atom H yang berikatan dengan atom H lagi, keduanya memiliki nilai keelektronegatifan masing-masing 2,1. Contoh lainnya adalah minyak.
Baca juga: Struktur Lewis Asam Sulfat H2SO4
Baca juga: Reaksi Hidrokarbon, Subtitusi, Adisi dan Eliminasi
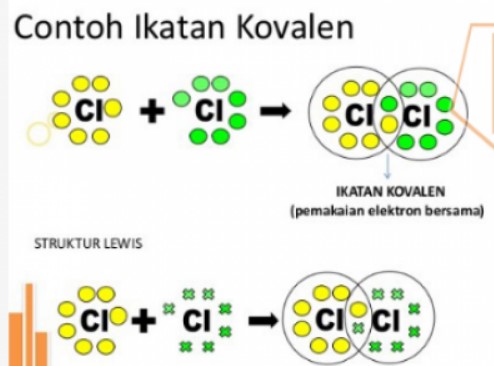
Contoh Ikatan Kovalen
Gambarkan struktur Lewis dari molekul Cl2
Penyelesaian :
Atom klorin dengan nomor 17 mempunyai konfigurasi elektron 1s2 2s2 2p6 3s2 3p5. Elektron valensi atom Cl = 7 untuk memperoleh 8 elektron (oktet) pada kulit terluarnya dibutuhkan 1 elektron.
Oktet akan terjadi bila masing-masing atom klorin saling menyumbang 1 elektron sehingga antara kedua atom klorin ini terdapat satu pasang elektron yang dipakai bersama. Tiap sepasang elektron ikatan digambarkan dengan garis.
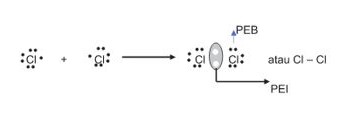
Disamping itu, ikatan kovalen dibagi menjadi tiga bagian, diantaranya ikatan kovalen tunggal, rangkap dua, dan rangkap tiga.