Baca Juga: Sifat Besi Secara Kimia dan Secara Fisika
Dengan mengetahui susunannya, kita harus mengetahui hal dasar selanjutnya berupa sifat keteraturan tabel periodik. Untuk itu, pada kesempatan kali ini akan disampaikan mengenai sifat keteraturan tabel periodik. Berikut pembahasannya.
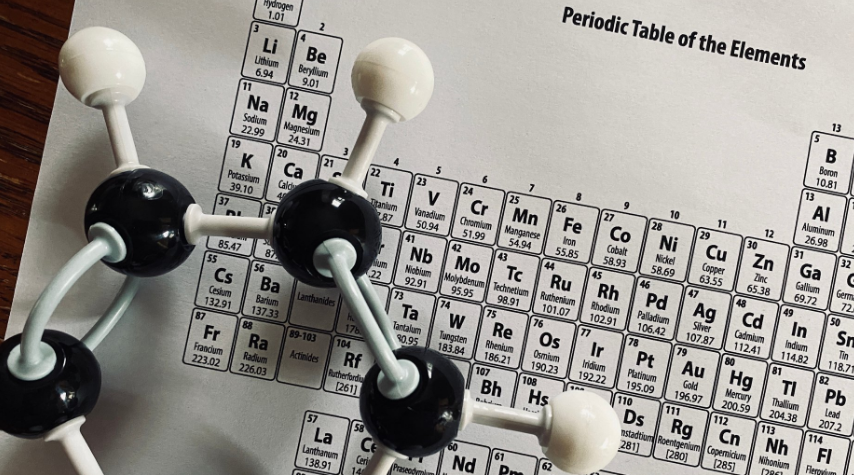
Pengertian Tabel Periodik
Setiap unsur kimia dalam tabel periodik merupakan bagian dari unsur-unsur zat yang terdiri atas berbagai macam informasi. Tujuan dibuatnya tabel periodik unsur adalah untuk mengenal nama unsur dari partikel kimia secara mudah melalui pengelompokan. Susunannya dapat ditampilkan berdasarkan nomor atom dan kesamaan sifat kimianya.
Pengelompokan tabel periodik sendiri dilakukan berdasarkan sifat fisik dan sifat kimia dari setiap unsur-unsur yang telah dituangkan oleh para ahli kimia dalam bentuk tabel unsur. Tentunya, fungsi tabel periodik unsur akan membantu kita dalam mengetahui nomor atom, konfigurasi elektron, dan mempelajari setiap sifat-sifat unsur beserta keteraturannya.
Sifat Keteraturan Tabel Periodik
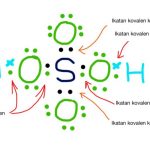
Hampir semua unsur yang ada di alam itu ditemukan dalam bentuk senyawanya. Hal tersebut disebabkan unsur itu belum stabil sehingga mudah bereaksi dengan unsur lainnya. Reaktif atau tidaknya suatu unsur dipengaruhi oleh harga titik didih, titik leleh, jari-jari atom, energi ionisasi, keelektronegatifan dan afinitas elektronnya.
Berdasarkan gambar tabel periodik, akan terlihat beberapa angka yang ternyata memiliki keteraturan sifat unsur. Hal ini didasari oleh jari-jari atom, keelektronegatifan, energi ionisasi, logam dan non-logam, serta afinitas elektron. Berikut penjelasannya.
1. Jari-jari atom
Jari-jari atom memiliki makna yang berhubungan dengan jarak dari inti atom sampai kulit terluar suatu atom. Secara periodik, jari-jari atom akan cenderung semakin besar dalam satu golongan dari atas ke bawah. Hal itu disebabkan karena bertambahnya nomor atom beserta kulit elektron dalam satu golongan.
2. Energi ionisasi
Ionasi adalah perwujudan energi yang digunakan untuk melepaskan elektron dan terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Secara periodik, dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah.
3. Afinitas Elektron
Pada penggambaran tabel periodik, afinitas elektron secara periodik terlihat dalam satu golongan dari atas ke bawah. Afinitas elektron cenderung berkurang (semakin kecil) dari kiri ke kanan sampai golongan VII A, dan cenderung bertambah (semakin besar) kecuali unsur alkali tanah dan gas mulia.
Baca Juga: Rumus Gas Ideal, Pembahasan dan Contoh Soal