Mr Na3PO4 = Ar Na x 3 + Ar P x 1 + Ar O x 4
Contoh Soal:
1. Diketahui 46 gram logam Na tentukan jumlah molnya diketahui Ar Na =23!
2. Tentukan massa dari 2 mol CaCO3 jika diketahui (Ar Ca = 40, Ar C =12, Ar O =16)
Jawaban:
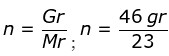 ; n = 2 mol
; n = 2 mol- Gram = n x Ar/Mr
Gr = 2 x Mr CaCO3
Mr CaCO3 = Ar Ca x 1 + Ar C x 1 + Ar O x 3 = 40 x 1 + 12 x 1 + 16 x 3 = 40 + 12 + 48 = 100
Gr = 2 x Mr CaCO3
Gr = 2 x 100
Gr = 200 gram
Baca Juga: Hukum Dasar Kimia untuk Stoikiometri Kimia Kelas 10 Lengkap Dengan Rumus
Baca Juga: Konsep Dasar Stoikiometri dalam Konsep Mol dan Senyawa Lainnya Lengkap
Baca Juga: Jenis Jenis Stoikiometri dan Pembahasannya Lengkap
Hubungan mol dengan Volume pada kondisi STP (Standar Temperature and Pressure)
Kondisi STP merupakan kondisi standar dimana pada kondisi tersebut Tekanannya (P) = 1 atm dan suhunya (T) = 00C. Volume (V) pada kondisi STP untuk 1 mol nilainya 22,4 Liter sedangkan selain 1 mol volumenya dapat dihitung dengan rumus:
 atau V = n x 22,4 L
atau V = n x 22,4 L
Keterangan : V = volume (Liter)
Tambahan : 1 Liter = 1000 mL
Contoh Soal:
- Berapa jumlah mol 44,8 L gas oksigen yang diukur pada keadaan standar?
- Berapa Liter volume 0,5 mol gas hidrogen jika diukur pada keadaan STP?
Jawaban:
Hubungan mol dengan Volume pada kondisi Non STP
Kondisi Non STP merupakan kondisi dimana Tekanannya (P) tidak sama dengan 1 atm atau suhunya (T) tidak sama dengan 00C. Volume dan mol dapat dihitung dengan rumus:
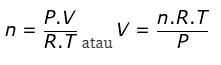
Keterangan:
V = Volume (Liter)
P = Tekanan (atm) jika dikonversi 1 atm = 76 cmHg atau 1 atm = 760 mmHg
n = mol
R = Tetapan gas umum ( 0,082 Latm/kmol)
T = Suhu (Kelvin) jika dikonversi dari celcius maka Kelvin = celcius + 273
Contoh Soal:
Berapa Volume 2 mol N2 jika diukur pada suhu 25 0C dan tekanan 1 atm?
Jawaban:
T = 250C + 273 = 298 K
 ; V = 48,87 Liter
; V = 48,87 Liter
Hubungan mol dengan koefisien
Berdasarkan rumusan mol dapat dijelaskan bahwa:
Perbandingan jumlah mol akan sama dengan perbandingan jumlah partikelnya
Misalnya:
1 Mol O2 : 2 Mol = 6,02 x 10 23 molekul O2 : 12,04 x 10 23 molekul O2
Perbandingannya sama yaitu 1 : 2
Telah dijelaskan pada hukum avogadro bahwa:
Perbandingan jumlah partikel akan sama dengan perbandingan koefisien.
Dari rumusan di atas diperoleh kesimpulan :
Perbandingan Mol = Perbandingan Koefisien
N2(g) + 3 H2(g) → 2NH3(g)
1 mol 3 mol 2 mol
atau