Rumus Stoikiometri dan Contoh Soal Dalam Kehidupan Sehari Hari – Pembahasan stoikiometri dalam dunia kimia berhubungan dengan penghitungan relasi kuantitatif rumus kimia dan persamaan kimia. Ilmu stoikiometri digunakan untuk mempelajari kuantitas produk dan reaktan dalam reaksi kimia. Dengan kata lain stoikiometri adalah perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi. Reaksi dikatakan termasuk reaksi stoikiometri apabila reaktan dalam reaksi habis seluruhnya.
Stoikiometri memiliki dasar-dasar hukum kimia yang beragam, mulai dari hukum kekekalan massa, hukum perbandingan tetap, hukum perbandingan berganda, hukum Boyle, dan hukum Boyle-Gay Lussac. Tentunya, hal ini membuat pembahasan stoikiometri memiliki beberapa dasar dengan rumus-rumus terkait yang berkaitan dengan penghitungan. Selain itu, dalam stoikiometri masih berhubungan dengan konsep mol dan massa molar yang menjadi bahan penghitungannya.
Baca Juga: Sifat Besi Secara Kimia dan Secara Fisika
Baca Juga: Pembahasan dan Cara Menentukan Pereaksi Pembatas
Baca Juga: Cara Menghitung Kalori Makanan Untuk Diet Sehat
Pada kesempatan kali ini kalian akan mempelajari mengenai rumus stoikiometri dan beberapa contoh soalnya. Berikut pembahasannya.
Konsep stoikiometri
Stoikiometri merupakan bahasa serapan dari bahasa Yunani yaitu stoicheion yang memiliki makna unsur dan metrcin adalah mengukur. Stoikiometri menjadi ilmu yang mempelajari kuantitas produk dan reaktan dalam reaksi kimia. Dengan kata lain, stoikiometri adalah perhitungan kimia yang menyangkut hubungan kuantitatif zat yang terlibat dalam reaksi. Reaksi dikatakan termasuk reaksi stoikiometri apabila reaktan dalam reaksi habis seluruhnya.
Dalam pembahasan konsepnya, stoikiometri akan berhubungan dengan hukum-hukum dasar kimia seperti berikut.
- Hukum kekekalan massa (Lavoisier pada tahun 1774) “Massa total suatu bahan sesudah reaksi kimia sama dengan massa total bahan sebelum reaksi”. Contoh: 2 gram Hidrogen bereaksi dengan 16 gram Oksigen membentuk 18 gram air (H2O).
- Hukum perbandingan tetap (Joseph Proust tahun 1799) “Perbandingan massa unsur -unsur penyusun suatu senyawa selalu tetap.”
- Hukum perbandingan berganda (John Dalton tahun 1803) “Bila dua unsur dapat membentuk lebih dari satu senyawa, maka perbandingan massa unsur yang satu, yang bersenyawa dengan unsur lain yang tertentu massanya, merupakan bilangan bulat dan sesederhana.”
- Hukum Gay Lussac dan Hipotesis Avogadro “Pada suhu dan tekanan yang sama, perbandingan volume gas gas yang terlibat dalam suatu reaksi setara dengan perbandingan jumlah partikelnya yang artinya akan setara dengan perbandingan koefisien reaksi tersebut.”
Rumus stoikiometri
Adapun rumus umum yang diterapkan dalam penghitungan stoikiometri dijelaskan sebagai berikut.
1. Dasar stoikiometri larutan
Pada dasar ini berhubungan dengan konsentrasi larutan yang menyatakan jumlah zat terlarut yang dilarutkan dalam sejumlah tertentu pelarut atau sejumlah tertentu larutan. Konsentrasi larutan dapat dinyatakan dalam molaritas. Molaritas (M) didefinisikan sebagai jumlah mol zat terlarut per liter larutan.
Baca Juga: Struktur Lewis Asam Sulfat H2SO4
Baca Juga: Contoh Soal Reaksi Hidrokarbon dan Pembahasan
Baca Juga: Tata Nama Alkohol IUPAC dan Trivial
M = n : V
2. Dasar Stoikiometri Gas Ideal
Berhubungan dengan volum molar atau Vm yang didefinisikan sebagai volum dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari volum molar (Vm) adalah L/mol.
Vm = V : n
Hukum Avogadro menyatakan bahwa pada tekanan dan temperatur tertentu dan tetap, volum gas secara langsung berbanding lurus terhadap jumlah gas.
V ∞ Nn [P, T konstan]
v : n = konstanta
Vm = konstanta
Pada keadaan STP (P = 1 atm, T = 273 K), Vm gas ideal = 22,414 L/mol
Pada keadaan RTP/ATP (P = 1 atm, T = 298 K), Vm gas ideal = 24 L/mol
Pada keadaan tertentu, berlaku hukum gas ideal: PV = nRT
3. Konsep mol
Konsep mol memiliki beberapa hal dasar seperti berikut.
– massa atom relatif

– massa molekul relatif

Contoh Soal
Logam alkali (golongan 1) bereaksi dengan halogen (golongan 17) membentuk senyawa ionik logam halida. Berapa gram kalium klorida yang terbentuk dari reaksi 5,25 L gas klorin pada tekanan 0,950 atm dan temperatur 293 K dengan 17,0 g kalium?
Pembahasan:

Konsep Mol
Mol merupakan satuan jumlah yang digunakan para ahli kimia untuk menentukan jumlah zat.
Satuan jumlah yang sering digunakan dalam kehidupan sehari-hari misalnya:
1 Lusin = 12 buah
1 mol = 6,02 x 1023 partikel zat
Bila terdapat 1 mol molekul H2O maka terdapat 6,02 x 1023 molekul H2O
Bila terdapat 1 mol atom Fe maka terdapat 6,02 x 1023 atom Fe
Rumusan Mol
Hubungan mol (n) dengan Jumlah Parikel (JP)
Dijelaskan bahwa 1 mol terdapat 6,02 x 1023 atau jika dibuat rumusan:
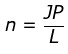 atau JP = n x L
atau JP = n x L
Keterangan:
n = mol
JP = Jumlah partikel
L = bilangan avogadro (6,02 x 1023)
Contoh Soal:
- Tentukan jumlah mol Fe dari 3,01 x 1022 atom Fe!
- Tentukan Jumlah molekul H2O dari 1,5 mol H2O!
- Tentukan Jumlah atom N dari 2 mol NH3!
- Tentukan Jumlah atom total dari 4 mol H2SO4!
Jawaban:
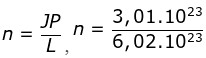 = 0,5 mol
= 0,5 mol- JP = n x L ; JP = 1,5 mol x 6,02 x 1023 molekul ; JP = 9,03 x 1023
- Untuk menentukan jumlah atom jika diketahui mol molekulnya menggunakan rumus JP = a x n x L
Keterangan:
JP = Jumlah atoma = Jumlah atom yang ditanyakan pada rumus molekul
n = mol
L = Bilangan Avogadro (6,02 x 1023)
Maka jumlah atom N dari 2 mol NH3 adalah:
JP = a x n x L
JP = 1 x 2 mol x 6,02 x 1023
JP = 12,04 x 1024 - Menggunakan rumus yang sama dengan no.3
JP = a x n x L
JP = 7 x 4 mol x 6,02 x1023
JP = 168,56 x 1023 = 1,68 x 1025
Hubungan mol dengan massa/gram
Massa molar (Mm) merupakan massa suatu zat jika jumlahnya 1 mol. Jika jumlahnya bukan 1 mol massa zat dapat dihitung dengan rumus:
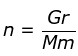 atau Gram = n x Mm
atau Gram = n x Mm
Massa molar atom akan sama dengan massa atom relatifnya (Ar)
Massa molar molekul akan sama dengan massa molekul relatifnya (Mr), sehingga rumusnya bisa berubah menjadi:
![]() atau Gram = n x Ar/Mr
atau Gram = n x Ar/Mr
Menentukan Ar bisa dilihat di SPU, nilai Ar sama dengan A (massa atom)
Menentukan Mr bisa dihitung dari penjumlahan Ar unsur penyusunnya dikali jumlah atomnya masing-masing. Contoh:
Mr H2SO4 = Ar H x 2 + Ar S x 1 + Ar O x 4