Pada pembahasan kali ini kalian akan mempelajari mengenai konfigurasi elektron. Berikut pembahasannya.
Konfigurasi Elektron
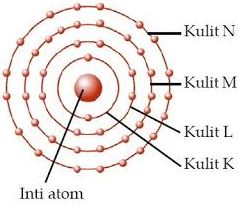
Konfigurasi elektron merupakan susunan elektron dalam tingkat energi di sekitar inti atom. Menurut teori atom, keberadaan elektron menempati beberapa tingkat dari kulit pertama yang terdekat dengan inti atom, yaitu kulit K, hingga kulit ketujuh Q, yang memiliki letak paling jauh dari inti atom. Oleh karena itulah, konfigurasi elektron disempurnakan dengan model mekanika kuantum yang menggunakan empat jenis subkulit untuk menggambarkan orbital elektron dalam suatu atom.
Pada pembuatan konfigurasi elektron dengan teori mekanika kuantum, ada satu gambar yang harus kalian pahami dulu sebelum membuat konfigurasi elektron berdasarkan orbital atom. Coba perhatikan gambar di bawah ini.
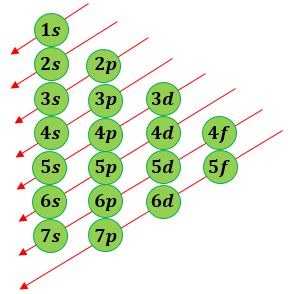
Gambar di atas adalah urutan tingkat energi kulit dan subkulit suatu atom. Ada 4 subkulit yaitu s, p, d, dan f. Angka sebelum subkulit menunjukkan kulit. Subkulit 1s punya tingkat energi paling rendah, lalu naik ke subkulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Pastinya, elektron yang bisa mengisi subkulit tertentu juga terbatas. Setiap subkulit memiliki kapasitas maksimal yang berbeda-beda untuk dapat menampung elektron.
- Subkulit s menampung maksimal 2 elektron.
- Subkulit p menampung maksimal 6 elektron.
- Subkulit d menampung maksimal 10 elektron.
- Subkulit f menampung maksimal 14 elektron.
Cara penulisan orbital dengan jumlah elektronnya adalah dengan menuliskan nomor kulit diikuti orbital, kemudian jumlah elektron yang terdapat dalam orbital tersebut. Contoh: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 ……..
Baca Juga: Rumus Kesebangunan Bangun Datar
Baca Juga: Cara Menghitung Simpangan Baku (Standar Deviasi)
Baca Juga: Pencerminan Terhadap Sumbu X Dan Sumbu Y
Contoh Soal Konfigurasi Elektron
Tentukan konfigurasi elektron dari 20Ca!
Jawab:
Ca memiliki jumlah elektron 20, maka konfigurasinya adalah:
1s2 2s2 2p6 3s2 3p6 4s2
Aturan Penuh dan Setengah Penuh
Aturan penuh dan setengah penuh pada konfigurasi elektron menyatakan jika suatu elektron dapat berpindah ke orbital lain agar mendapatkan susunan yang lebih stabil.
Aturan penuh dan setengah penuh ini dapat diterapkan untuk konfigurasi elektron yang memiliki akhir, yaitu pada bagian subkulit D.
Contohnya adalah pada atom CU yang memiliki konfigurasi akhir pada orbital 3D.
Berikut adalah konfigurasi atom CU tanpa aturan penuh/setengah penuh:
Cu : 1s2 2s2 2p6 3s2 3p6 4s2 3d9
Namun dengan aturan setengah penuh, orbital 3d cenderung mengambil elektron dari 4s untuk mencapai total 10 elektron.
Cu : 1s2 2s2 2p6 3s2 3p6 4s1 3d10