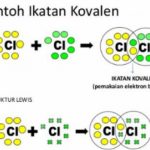
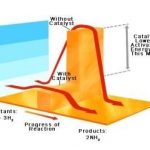
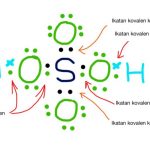
“Hasil kali tekanan gas dan volume gas akan selalu tetap jika dibagi suhu mutlak.”
Rumus:
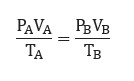
Perhitungan Stoikiometri
Pembahasan perhitungan kimia dalam sumber belajar ini ditekankan pada perhitungan kimia yang berhubungan dengan pemanfaatan koefisien pada reaksi kimia , konsep mol dan hukum-hukum yang berhubungan dengan sifat-sifat gas.
- Pengertian Mol
Untuk menyederhanakan jumlah partikel yang luar biasa kecilnya digunakan konsep mol. Mol menyatakan satuan jumlah zat. Kata mol berasal dari bahasa latin moles yang artinya sejumlah massa.
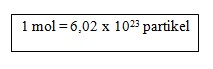
Bilangan ini sama dengan jumlah partikel yang ada dalam 1 mol atom C-12. Dengan kata lain standar mol adalah 12 gram C-12,jadi satu mol tiap zat mengandung 6,02 x 1023 partikel.
- Hubungan jumlah mol dengan jumlah partikel,massa dan volume zat
a. Hubungan jumlah mol dengan jumlah partikel

1) Mol mempunyai jumlah partikel (X) = 6,02 x 1023 = L
2) Mol mempunyai jumlah partikel (X) =2 x 6,02 x 1023 = 2L
b. Hubungan Jumlah Mol dengan Massa
Massa 1 Mol zat disebut Massa Molar (Mn) dengan satuan gram/mol (Ar= massa atom relatif, Mr = massa molekul relatif)

c. Hubungan Jumlah Mol dengan Volume Zat
Baca Juga: Konsep Dasar Stoikiometri dalam Konsep Mol dan Senyawa Lainnya Lengkap
Baca Juga: Jenis Jenis Stoikiometri dan Pembahasannya Lengkap
Baca Juga: Pembahasan dan Cara Menentukan Pereaksi Pembatas
1) Pada Keadaan STP
Volume molar adalah volume 1 mol gas yang diukur pada keadaan standar (STP) yaitu pada suhu 0oC (273) dan tekanan 1 atm (76 cmHg). 1 Mol gas pada STP volumenya adalah 22,4 liter.