Hukum Dasar Stoikiometri Kimia Kelas 10 – Materi stoikiometri menjadi salah satu pelajaran Kimia yang dapat dipelajari mulai di kelas 10. Materi ini menjadi materi dasar dan harus dipahami dengan baik agar pada pembahasan materi-materi selanjutnya sudah paham dasar-dasarnya.
Stoikiometri dalam dunia kimia berhubungan dengan penghitungan relasi kuantitatif rumus kimia dan persamaan kimia. Ilmu stoikiometri digunakan untuk mempelajari kuantitas produk dan reaktan dalam reaksi kimia. Dalam kehidupan sehari-hari, ilmu stoikiometri dapat dilihat pada penerapan pemupukan tanaman yang harus dilihat berdasarkan konsentrasi pengenceran pupuknya agar sesuai. Pemupukan tidak boleh dilakukan terlalu pekat atau terlalu encer karena dapat mempengaruhi proses metabolism dalam tanaman. Nah, proses penentuan komposisi kimia dalam pupuk ini membutuhkan perhitungan stoikiometri yang tepat.
Baca Juga: Sifat Besi Secara Kimia dan Secara Fisika
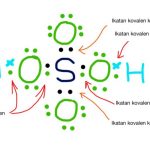
Baca Juga: Struktur Lewis Asam Sulfat H2SO4
Baca Juga: Notasi Ilmiah Fisika Kelas 10 SMA
Pada penghitungan stoikiometri memerlukan hukum-hukum dasar kimia dan di kesempatan kali ini akan disampaikan beberapa materi yang terkait. Berikut pembahasannya.
Hukum Dasar Kimia untuk Stoikiometri
Dalam pembahasan stoikiometri memiliki beberapa hukum dasar yang melatarbelakanginya dan pemahamannya sangat diperlukan untuk mempelajari konsep-konsep dari stoikiometri. Berikut beberapa hukum dasar di Kimia yang membahas mengenai stoikiometri.
1. Hukum Kekekalan Massa (Hukum Lavoiser)
Hukum kekekalan massa menyatakan massa total suatu bahan sesudah reaksi kimia sama dengan massa total bahan sebelum reaksi. Contohnya, massa kayu yang belum dibakar memiliki massa yang sama dengan hasil pembakarannya.
2. Hukum Perbandingan Tetap (Hukum Proust)
Hukum perbandingan tetap tercipta dari gagasan Joseph Proust pada tahun 1799 dan menyatakan perbandingan massa unsur-unsur penyusun suatu senyawa selalu tetap. Contohnya, perbandingan massa Hidrogen dan Oksigen dalam air adalah 1:8 dan hal ini tidak bergantung pada jumlah air yang dianalisis.
3. Hukum Perbandingan Berganda (Hukum Dalton)
Hukum perbandingan berganda dikemukakan oleh John Dalton pada tahun 1803 yang menyatakan apabila ada dua unsur yang dapat membentuk lebih dari satu senyawa, perbandingan massa unsur yang satu yang bersenyawa dengan unsur lain yang tertentu massanya adalah bilangan bulat dan sederhana. Contohnya, jika Hidrogen yang bereaksi masing-masing 1 gram, H2O (air) yang terbentuk akan mengandung 4 gram oksigen, dan 8 gram pada H2O2 (Hidrogen Peroksida).
4. Perbandingan Volume (Hukum Gay Lussac)
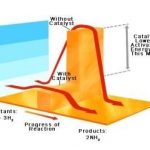
Hukum Gay Lussac dikenal juga dengan hukum Perbandingan Volume. Hukum ini dicetuskan oleh ilmuwan asal Prancis, yaitu Joseph Gay Lussac. Berdasarkan penelitiannya, Lussac mengambil kesimpulan bahwa perubahan volume gas dipengaruhi oleh suhu dan tekanan. Contohnya, pada suhu dan tekanan tertentu, 1 liter gas Nitrogen bisa bereaksi dengan 3 liter gas Hidrogen, hingga menghasilkan 2 liter gas amonia (2NH3).

5. Hipotesis Avogadro
Hipotesis Avogadro dapat dijadikan hukum dasar kimia yang dinyatakan oleh seorang ilmuwan asal Italia, yaitu Amadeo Avogadro. Ia menyatakan bahwa partikel unsur tidak selalu berupa atom yang berdiri sendiri, melainkan bisa berbentuk molekul unsur. Contohnya, H2, O2, N2, dan P4.
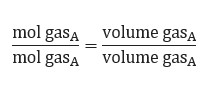
Baca Juga: Tata Nama Alkohol IUPAC dan Trivial
Baca Juga: Reaksi Hidrokarbon, Subtitusi, Adisi dan Eliminasi
Baca Juga: Zat Makanan dengan Energi Tertinggi Pada Satuan yang Sama
Berdasarkan pemikiran Avogadro, ia berhasil menjelaskan hukum Gay Lussac dan membuat hipotesis yang terjadi pada tekanan dan suhu yang sama menyebabkan perbandingan gas yang memiliki jumlah volume sama akan mempunyai jumlah molekul yang sama pula.
6. Hukum Boyle (Ketetapan Hasil Kali Tekanan dan Volume)
“Hasil kali tekanan gas dan volume gas akan selalu tetap jika diukur pada suhu dan tekanan yang sama.”
Rumus:
PA.VA = PB.VB
7. Hukum Boyle-Gay Lussac