– Periode ke-3, terdiri atas 8 unsur.
– Periode ke-4, terdiri atas 18 unsur.
– Periode ke-5, terdiri atas 18 unsur.
– Periode ke-6, terdiri atas 32 unsur, 18 unsur seperti period eke-4 dan ke-5, 14 unsur deret lantanida.
– Periode ke-7, merupakan periode unsur yang belum lengkap. Terdapat deret aktinida.

Sifat-Sifat Unsur Kimia
– Sifat Unsur
Berdasarkan sifat, unsur bisa dibagi ke dalam 3 jenis, yaitu logam, non logam, dan juga metalloid. Pada logam memiliki sifat yang cenderung melepaskan elektron dari non logam untuk membentuk ion positif. Sementara untuk non logam, cenderung menerima elektron dari logam. Lain halnya dengan unsur-unsur metalloid, yang memiliki kedua sifat seperti logam dan non logam.
– Jari-jari Atom
Jari-jari atom memiliki makna yang berhubungan dengan jarak dari inti atom sampai kulit terluar suatu atom. Secara periodik, jari-jari atom akan cenderung semakin besar dalam satu golongan dari atas ke bawah. Hal itu disebabkan karena bertambahnya nomor atom beserta kulit elektron dalam satu golongan.
– Kereaktifan
Kereaktifan sebuah unsur pada tabel periodik unsur dari kiri ke kanan dalam satu periode bertambah hingga golongan VIIA.
– Energi Ionisasi
Energi Ionasi adalah perwujudan energi yang digunakan untuk melepaskan elektron dan terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Secara periodik, dalam satu golongan, dari atas ke bawah, energi ionisasi semakin kecil dalam satu periode, dari kiri ke kanan, energi ionisasi cenderung bertambah.
– Afinitas Elektron
Pada penggambaran tabel periodik, afinitas elektron secara periodik terlihat dalam satu golongan dari atas ke bawah. Afinitas elektron cenderung berkurang (semakin kecil) dari kiri ke kanan sampai golongan VII A, dan cenderung bertambah (semakin besar) kecuali unsur alkali tanah dan gas mulia.
– Keelektronegatifan
Kelektronegatifan merupakan kemampuan atau kecenderungan suatu atom untuk menangkap ataupun menarik kembali elektron dari atom lainnya.
– Logam dan Non Logam
Logam dan non logam menjadi suatu kecenderungan atom untuk melepas elektron dan membentuk ion bermuatan positif (tergantung dengan energi ionisasi). Sifat logam berkaitan dengan keelektropositifan yang diartikan apabila semakin besar energi ionisasinya maka sifat logamnya akan berkurang. Hal ini karena sulit melepas elektron. Sementara itu, sifat non logam berkaitan dengan keelektronegatifan, yakni kecenderungan atom untuk menyerap elektron.
Baca Juga: Gambar Tabel Periodik dan Cara Membacanya
Baca Juga: Sifat Unsur Dalam Tabel Periodik dan Urutannya
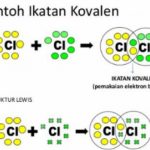
Baca Juga: Ikatan Kovalen Tunggal dan Rangkap
Demikian pembahasan mengenai kelompok unsur pada tabel periodik. Semoga materi kali ini dapat bermanfaat, ya.